Virussen
Algemeen
De jongste discipline binnen ILVO-Plant-Gewasbescherming en dus ook binnen het diagnosecentrum heeft de voorbije anderhalf jaar een gestaag groeiende vraag naar detectie van virussen, viroïden en fytoplasma’s gekend. Inspelend op de aanvragen werden intussen talrijke diagnostische protocols voor de detectie van plantenvirussen en aanverwante pathogenen via de klassieke ELISA methode geïmplementeerd. Daarnaast werden ook een groot aantal PCR-gebaseerde detectiemethodes gevalideerd. Ook deze worden courant, zowel als bevestigingsmethode van de serologische testen, of als preferentieel gekozen diagnostische test toegepast.
Optimalisatie (indien nodig ook de ontwikkeling van nieuwe testen) en validatie van diverse detectie- en identificatietoetsen voor de (economisch) belangrijkste plantenvirussen en aanverwante organismen (incl. fytoplasma’s en Candidatus Liberibacter) blijven ook in de toekomst prioritair.
Het labo virologie bezit een ISO17025 accreditatie voor de detectie van plantpathogene virussen via de DAS- en TAS-ELISA methode en de real-time PCR gebaseerde detectie (als bevestigingstest) voor de detectie van het tomatengeelkrulbladvirus (Tomato yellow leaf curl virus; TYLCV) en het pruimensharkavirus (Plum pox virus; PPV). In opdracht van het Federaal Agentschap voor de veiligheid van de voedselketen (FAVV) voert het labo voor de in de accreditatiescope opgenomen organismen de officiële testen uit voor de controles die worden uitgevoerd in het kader van nationale surveys en import/export controle acties. Bijkomend heeft het labo ook een erkenning voor het uitvoeren van de officiële diagnostische testen voor de planten en plantendelen die mogelijk geïnfecteerd zijn door het chrysantenstengelnecrosevirus (Chrysanthemum stem necrosis virus; CSNV), het chrysantendwergziekteviroïde (CSVd), het appelproliferatiefytoplasma (Apple proliferation phytoplasma; AP) en perenaftakelingsfytoplasma (Pear decline phytoplasma; PD).
Voor de certificatie van aardappelpootgoed werden directe PCR gebaseerde detectietechnieken op knollen geïmplementeerd voor de belangrijkste aardappelvirussen (PVY, PVX, PLRV, PVS, PVA en PVM). Deze PCR techniek werd slechts een 5-tal jaar terug erkend als officieel te gebruiken test met betrekking tot het certificeringsprogramma van pootgoedaardappelen.
 |
| Virussymptomen – van links naar rechts - op chrysant (tomatenbronsvlekkenvirus), vlinderorchidee (Odontoglossum-kringvlekkenvirus) en courgette - op plant (watermeloenmozaïekvirus) en vrucht (komkommermozaïekvirus) |
De diagnostische procedure
Het laboratorium virologie van het DCP is in staat om de meeste gekende plantenvirussen en fytoplasma’s op te sporen. Voor de meeste gerichte diagnostische testen (vermoeden over welk virus het gaat, of een specifieke vraag) wordt gebruik gemaakt van de DAS- of TAS-ELISA methode, RT-PCR of real-time PCR methode, naargelang de beschikbaarheid, betrouwbaarheid en de relevantie van de methode.
In de zoektocht naar schade van onbekende oorsprong wordt eerst een visueel onderzoek uitgevoerd. Als er op basis van de symptomatologie indicatie is voor een gekende virusziekte dan worden één of meerdere serologische testen en PCR-testen uitgevoerd. Deze testen kunnen eventueel al snel een resultaat opleveren. Daarnaast worden met geïnfecteerd plantenweefsel ook infecties uitgevoerd op een reeks van specifieke indicatorplanten (biotoets). Na 2-4 weken worden deze indicatorplanten beoordeeld op typische virale symptoomontwikkeling (lesies/necroses, mozaïek, misvormingen, enz.). Heel wat planten worden voor diagnose aangeboden met een schadebeeld dat wel viraal van oorsprong zou kunnen zijn, maar waarbij de verantwoordelijke virus niet direct duidelijk kan geïdentificeerd worden. In dit geval zijn de testen met indicatorplanten vaak de enige optie.
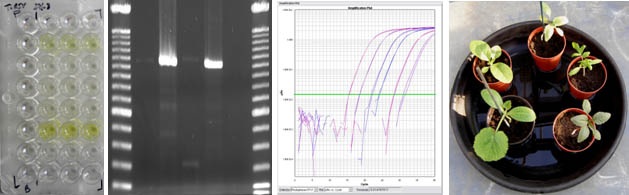 |
| Beoordeling van resultaten van een virusanalyse – van links naar rechts - via kleuromslag door binding van enzymgemerkte antilichamen op de eiwitmantel van het aanwezige virus (ELISA), zichtbaar maken van DNA-fragmenten via gelelectroforese ((RT) PCR), op basis van amplificatiecurves die fluorescentie-intensiteit weergeven ten opzichte van het aantal PCR-cycli (TaqMan qPCR) en interpretatie van symptoomvorming op mechanisch geïnfecteerde indicatorplanten (biotoets). |
 Diagnosecentrum voor Planten
Diagnosecentrum voor Planten